NESTE TEMA
Gastrointestinale allergier
01
Eosinofil øsofagitt (øsofagitt) (EoE)
Beskrivelse.
Eosinofil øsofagitt (EoE) er den hyppigste eosinofile gastrointestinale forstyrrelsen, og er kjennetegnet ved i) øsofagale symptomer inkludert spisevegring, gastroøsofagal refluks-sykdom (GERD), dysfagi og mat som setter seg fast i spiserøret, og ii) en eosinofil dominerende inflammasjon på > 15 eosinofiler pr. høyeffektsfelt (HPF; standard størrelse på ca. 0,3 mm2) i øsofagusvevet etter utelukkelse av andre forstyrrelser forbundet med like kliniske histologiske eller endoskopiske trekk.2,3 Det er også blitt beskrevet som en "matantigen-mediert sykdom".4 Matallergi-assosiert EoE er vanligvis assosiert med 6 matvarer, nemlig kumelk, hvete, soya, egg, nøtter og fisk4, men kan variere etter region og mellom individer.
Prevalens.
Utbredelsen av EoE har økt kraftig i løpet av de siste to tiårene, delvis på grunn av økt bevissthet og bedre oppdagelse av sykdom.5 Data fra USA rapporterte i 2018 at den totale utbredelsen var 68 per 100 000 (~0,68/1000) barn < 10 år og fra 115-123 per 100 000 (~1/1000) barn og ungdom (10) 0-19 år).5
I en samleanalyse av 14 studier, både voksne og barn, i Nord-Amerika og Europa, ble den totale prevalensen av EoE i barna antatt å være 34,4 tilfeller/100 000 (0,34/1000).6 Ifølge andre nyere studier i Spania var imidlertid prevalensen noe høyere hos menn enn kvinner på 53,4 tilfeller/100 000 (0,54/1000).6 Videre synes EoE å være konsekvent høyere hos menn enn kvinner på tvers av alle alderdgrupper.5-7
Kostbehandling
Hos pasienter med symptomatisk EoE er protonpumpehemmere (PPI-er), glukokortikosteroider og eliminasjonsdiett effektivt for å indusere histologisk og klinisk remisjon.7,8 En 6-food eliminasjonsdiett er å foretrekke fremfor en 2 eller 4-food eliminasjonsdiett, men er forbundet med mindre etterlevelse og høyere antall endoskopier.7 En step-up tilnærming er også blitt anbefalt, ved å starte med de to oftest impliserte matvarene, dvs. kumelk og hvete/gluten (2-food eliminasjonsdiett (2-FED); og hos de som mislykkes med 2-mat eliminasjonsdiett blir 4-FED initiert og så videre til 6-FED.9 I denne studien oppnådde >40% av barna remisjon på 2-FED, 60% med 4-FED og 79% med 6-FED.9
Historisk sett ble elementaldiett av og til brukt fordi det er effektvit, men idag har den en begrenset rolle å spille ved håndtering av EoE-grunnet dårlig etterlevelse.7 Det anbefales at disse diettene derfor er forbeholdt (bare) barn med refraktær EoE når vanlige behandlinger har feilet.7 I mellomtiden er allergitesting for matvarer (f.eks. skin prick, spesifikk IgE og plastertesting) ikke å anbefale som metode for å velge hvilke matvarer som skal begrenses.7 Når terapien er blitt initiert (diett eller farmakologisk), så utføres en endoskopi med biopsi vanligvis mens behandlingen utføres - siden symptomene ikke alltid korrelerer med histologisk aktivitet.7 Endoskopiske prosedyrer som dilatering kan vurderes i noen (alvorlige) tilfeller med fibrostenotisk sykdom.7
02
Food Protein-Induced Enterocolitis Syndrome (FPIES)
Beskrivelse.
FPIES er en ikke-IgE-mediert matallergi som typisk oppstår i spedbarnsalderen, med gjentatte langvarige brekninger.10,11 Det er blitt rapportert at i tilfeller med akutt FPIES, begynner brekningene omtrent 1 til 4 timer etter matinntak, ofte ledsaget av letargi og blekhet.10,11 Videre er det blitt rapportert om vandig diaré (av og til med blod og slim) i løpet av 5 til 10 timer etter inntak av den impliserte maten som varer i opptil 24 timer.10,11 Potensielle bivirkninger av akutt FPIES er dehydrering, som kan føre til hypotensjon og sjokk når de er kraftige.10,11 Symptomer på akutt FPIES forsvinner imidlertid vanligvis innen 24 timer og de fleste barn med akutt FPIES, er friske mellom episodene og har normal vekst.10,11
Kronisk FPIES ses oftest hos spedbarn yngre enn 4 måneder som får morsmelkerstatning basert på melk eller soya, hvor den maten som gir symptomer inntas regelmessig og gjentatte ganger.10,11 Symptomer forekommer som kronisk/intermitterende oppkast, vandig diaré, hypoalbuminemi og sviktende tilvekst.10,11. Ved eliminering av mat som trigger forsvinner symptomene, men ved påfølgende provokasjon (utilsiktet eksponering eller kontrollert) kan det indusere en akutt FPIES-episode innen 1 til 4 timer etter matinntak.10,11
Kumelk ser ut til å være den mest impliserte flytende maten i FPIES - man så at 58 % hadde reaksjon på kumelk ved matprovokasjon (OFC) i en studie.12 Mens en kombinasjon av soya og kumelk ser ut til å være vanlig knyttet til FPIES i USA (25 % til 50 %) samt ris og havre.10 Generelt sett er de mest vanlig rapporterte utløsende matvarene melk og soya for flytende mat og korn (ris, havre) som fast mat.11 Hos de fleste barna (65 %) synes imidlertid FPIES å være forårsaket av ett enkelt næringsmiddel.13
Prevalens.
Den kumulative insidensen estimert i USA, Israel, Australia og Spania varierer fra 15 til 700 tilfeller/100,000 (0.15-7/1000).14 En befolkningsbasert undersøkelse i USA rapporterte en estimert livstidsprevalens på 510 tilfeller /100,000 (~5/1000) i 18 år og 220 tilfeller/100,000 (~2/100) blant voksne.15 I vestlige land er prevalensen av FPIES i barndommen til kumelk rapportert til 340 tilfeller/100.000 (~3/1000). 16
Kostbehandling
Akutte FPIES håndteres i henhold til alvorlighetsgraden hos det enkelte barn; mildere reaksjoner kan gå over med oral rehydrering, mens moderate til alvorlige reaksjoner krever større tiltak, inkludert væskeresuscitering (med gjentatte boluser).11 Langtidsbehandling av FPIES omfatter at utløsende mat(varer) unngås, overvåking av kosthold og ernæring, behandling av reaksjoner ved utilsiktet inntak eller ny utløsende mat, og ny vurdering rundt resolusjon.11 For spedbarn med kumelk- eller soyarelatert FPIES, oppfordres amming eller bruk av en ekstensivt hydrolysert spesialnæring (eHF).11 FPIES-retningslinjer anbefaler ikke rutinemessig unngåelse av allergener hos ammende mødre med mindre barnet viser symptomer mens barnet ammer (noe som er sjeldent).16 De fleste spedbarn vil tolerere en eHF, men 10-20 % kan ha behov for en aminosyrebasert spesialnæring(AAF).10,11 I FPIES varierer de totale remisjonsratene fra 50 til 90 % ved 6 års alder, og tidspunktet for remisjon synes å være avhengig av både den impliserte maten og populasjonen som undersøkes.13 Toleranse for kumelk og soya oppnås vanligvis tidligere enn korn eller andre faste næringsmidler.11
03
Food Protein-Induced Enteropathy (FPE)
Beskrivelse.
Enteropati fremkalt av matvarer (noen ganger kalt kumelksensitiv enteropati) er et uvanlig syndrom med tynntarmsskade som fører til malabsorpsjon.13 Symptomer ved FPE omfatter ikke-blodig diaré, malabsorpsjon, enteropati med proteintap, hypoalbuminemi og redusert tilvekst.13 Den kjennetegnes også av abnormal mukosa i tynntarm og kroniske gastrointestinale symptomer mens mat inntas regelmessig.13 FPE starter typisk i de første månedene i livet, vanligvis i løpet av uker etter innføringen av kumelk, og opptrer som tilbakevendende oppkast, (ikke-blodig) diaré, malabsorpsjon, sviktende vekst, oppblåst mage og hypoalbuminemi.17-19 Kumelkprotein og soya er ofte implisert, men andre protein som hvete og egg er også rapportert.13,18,19 FPE kan være vanskelig å skille fra enkelte typer FPIES; selv om det mangler både akutte symptomer som ses i FPIES, og den kraftige dehydreringen og metabolske acidosen som ses i kronisk FPIES.18
Prevalens.
I en populasjonsbasert finsk studie var prevalensen av FPE mot melk hos eldre barn 200 tilfeller/100 000 (~22/1000).20 Selv om den totale prevalensen av FPE er ukjent, tyder rapporter på at prevalensen av dette ikke-IgE-medierte næringsmiddel-hypersensitivitetssyndromet har gått ned i løpet av de siste tiårene.13,18,19 Potensielle forklaringer på nedgang i prevalens av FPE omfatter bedre tilrettelegging for amming og utviklingen av bedre morsmelkerstatninger med lavere proteininnhold.18,19
Kostbehandling
Hjørnesteinen i behandling av FPE er å unngå maten som gir symptomer. I barn med FPE forsvinner symptomene vanligvis innen 1-4 uker etter eliminasjon av den aktuelle maten, selv om slimhinnereparasjon med normalisering av disakkaridaseaktivitet kan ta opptil 18 måneder å forbedre.13 I retningslinjer for morsmelkerstatning anbefales eHF som førstelinje, spesielt hos spedbarn under 6 måneder, og med tegn på at de ikke vokser optimalt. Dersom eHF ikke tolereres eller barnets første utløsningsreaksjon er eHF, anbefales AAF.13 Dersom kumelkfri diett ikke bedrer symptomene, kan andre eliminasjoner av mat (f.eks. soya, egg, hvete)være indisert, en etter en.18
04
Matproteinindusert prokotkolitt (FPIAP)
Beskrivelse.
FPIAP regnes som den mest godartede formen for ikke-IgE-mediert matallergi, og kjennetegnes av blod og av og til slim i avføringen hos ellers friske spedbarn med normal vekst.18 Det påvirker spedbarn < 12 måneders alder og vises vanligvis mellom 2 og 8 uker. Symptomene kan oppstå akutt (< 12 timer etter eksponering), men er vanligvis mer alvorlige med en gradvis økning i symptomer når proteinet introduseres.18 FPIAP-symptomatologi sees som lokalisert inflammasjon i distal tykktarm og forårsaker hematokesi (blod i avføringen) hos spedbarn som ellers ser friske ut19 (fig. 1). Det er antydet at det kan oppstå hos opptil 60 % av spedbarn som ammes.21 Kumelk er den hyppigste utløseren hos FPIAP (likt for FPIES og FPE), men soya er også implisert.19,21
Prevalens.
Av de ikke-IgE gastrointestinale matallergiene er FPIAP den hyppigste, selv om den eksakte prevalensen ikke er godt etablert.19 En stor studie av en israelsk fødselskohort fant at den totale prevalensen av FPIAP var relativt lav, på 160 tilfeller/100 000 (1,6/1000).22 Hos spedbarn med rektal blødning, har FPIAP blitt funnet å være årsaken i 18 - 64 % av tilfellene.23,24
Kostbehandling
De aller fleste barn med FPIAP som fullammes, vil respondere på at moren eliminerer melk fra sitt kosthold. Det kan imidlertid av og til være nødvendig å fjerne flere matvarer, vanligvis soya, egg og/eller hvete.16,19,21 Nyere europeiske retningslinjer anbefaler en 2-4 ukers eliminasjonssdiett for ammende mødre, etterfulgt av reintroduksjon av matvarer for å få bekreftet diagnosen.16 Når det ikke lykkes med eliminasjonsdiett for mor eller for de som ikke utelukkende ammer, kan det utprøves et ekstensivt hydrolysat. Når hematokesi imidlertid vedvarer, er en aminosyrebasert spesialnæring indisert.19,21 Soyadrikker kan indusere blødning i en undergruppe av spedbarn som reagerer på kumelk, så soya blir også ofte eliminert sammen med kumelk, i hvert fall i den diagnostiske perioden av eliminasjonsdietten.21
Figur 1. Gastrointestinale organer påvirket i de ulike ikke-IgE-medierte gastrointestinale matallergiene.
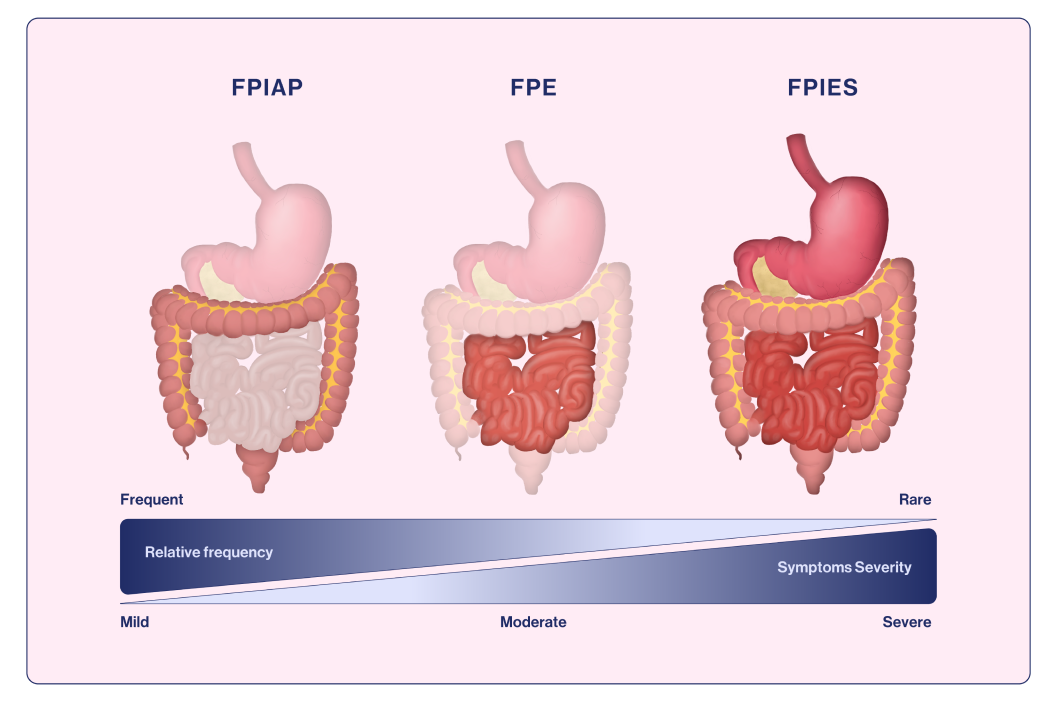
Tilpasset fra Labrosse et al., 202019
05
Allergiske dysmotilitetsforstyrrelser
Beskrivelse.
Gastro-øsofageal refluks (GER) er definert som passasjen av mageinnhold inn i øsofagus som oppstår i tidlig barndom og kan gi gulp og intermitterende oppkast.25 Når GER fører til plagsomme symptomer er det referert til som GER-sykdom (GERD).25 De vanlige GI-symptomene som tilskrives GERD er tilbakevendende oppgulping og oppkast hos spedbarn, med eller uten overdreven gråt, ubehag/irritabilitet, dystonisk halsposisjon, spiseproblemer og matavvisning, sviktende vekst og øsofagitt. I eldre barn kan symptomer også omfatte brystsmerter, epigastriesmerter og dysfagi.25
Mekanismene bak GERD er multiple, men den dominerende mekanismen skyldes transient relaksasjon av nedre øsofagussfinkter (LOS). Både IgE-mediert, ikke-IgE-mediert eller blandet IgE/ikke-IgE-mediert matallergi (inklusive KMPA) har vært implisert i patofysiologien til GERD.25 Matallergi-assosiert GERD, primært ikke-IgE-mediert, har blitt beskrevet hos små barn, der de fleste presenterer med symptomer i løpet av de første 6 måneder av livet, med mataversjon og sviktende vekst.25
Forholdet mellom matallergi og GERD er sannsynligvis toveis, der GERD-induserende endringer i mukosal immunitet kan øke risikoen for allergi, og allergibeslektede symptomer som manifestasjoner av gastrointestinal dysmotilitet kan igjen være på grunn av matallergeninduserte mediatorer.25
Prevalens.
Flere studier har undersøkt forekomsten av melkeproteinallerg hos spedbarn med symptomer som kan tilskrives GERD. I noen mindre eldre studier ble KMPA-assosiert GERD rapportert å ha prevalens fra 16-56%26-29, men en nyere gjennomgang konkluderte med at den reelle prevalensen av KMPA og GERD fortsatt er uklar.30
Kostbehandling
Det mest vanlige allergen som er angitt i matallergiassosiert GERD er kumelk i henhold til nyeste EAACI position paper.25 Det første steget i den diagnostiske prosessen er en detaljert klinisk historie, vurdering av vekst og mat-historie (inklusive eventuelle diettmessige endringer forbundet med forverring av symptomer) og bestemmelse av hvorvidt andre atopiske trekk er tilstede25 (fig. 2). Det bør også undersøkes om det er positiv historie i familien av atopi og tidlig eksem, noe som kan gi økt risiko for at barn får en allergisk sykdom.25 Når KMPA-assosiert GERD er fastslått, foreslår eksperter å vurdere melkefri diett før bruk av medisiner til (ikke-ammede) spedbarn.31 I EAACI-position paper foreslås det at minimum 2 uker på elimineringsdietten er nødvendig før symptomene vil begynte å forbedre seg.25 Det kan imidlertid ta opptil 6 uker i noen tilfeller, som deretter bør etterfølges av reintroduksjon av allergenet (som gis hver dag i alderstilpassede mengder i 2 uker).25 Eliminering av kumelk/melkeprodukter fra spedbarnskosten har vist seg å signifikant redusere eksponeringen av syre til øsofagus, noe som tyder på bedre peristaltisk øsofagusfunksjon.32
Amming bør støttes hos spedbarn med GERD, og en maternal eliminasjonsdiett bør bare vurderes hvis barnet har symptomer mens det ammes.25 Når det ikke er morsmelk tilgjengelig, eller barnet ikke bare ammes, anbefales en ekstensivt hydrolysert spesialnæring (eHF) som førstevalg. EAACI foreslo imidlertid at når spedbarnet har sviktende vekst, involvering av flere organsystem eller når det er mistanke om flere matallergier, kan en aminosyrebasert spesialnæring (AAF) vurderes.25 De indikerte også at fortykket eHF eller AAF kan gi noen ekstra fordeler hos spedbarn med pågående gastrointestinale symptomer.25
EAACI-paperet foreslo også at dersom symptomene ikke forbedres fullstendig (f.eks. på melkefri diett) og andre pågående symptomer fra lavere GI som kan være relatert til ikke-IgE-mediert matallergi og/eller atopisk dermatitt er til stedet, kan det være nødvendig å vurdere ytterligere elimineringer av mat (dvs. soya, egg og hvete).25
Etter 6-12 måneders eliminasjonsdiett (ved bekreftet matallergirelatert GERD) skal det igangsettes reintroduksjon med de aktuelle allergenene i henhold til EAACI-ekspertene.25
EAACI foreslår at protonpumpehemmere (PPI) kan brukes til småbarn og barn i skolen med matallergiassosiert GERD, mens farmakologiske behandlinger hos spedbarn (< 1 års alder) kun bør vurderes etter at en eliminasjonsdiett har mislyktes.25
Figur 2. Position paper fra EAACI foreslår denne prosessen for diagnostisering og teknikker av matallergiassosiert GERD.
Tilpasset fra Meyer et al., 202225
Referanser:
1). Heine RG. Chem Immunol Allergy. 2015;101:171-80.
2). Dellon ES, et al. Gastroenterology 2018; 155:1022-33.
3). Vandenplas Y, et al. JPGN. ESPGHAN. 2023.
4). Kliewer KL, et al. J Allergy Clin Immunol. 2016 Apr;137(4):1011-1014.
5). Kamat, Siddhesh, et al. The American Journal of Gastroenterology.2021; 116():p S184-S185,
6). Navarro P, et al., Alimentary Pharmacology & Therapeutics. 2019: 49: 1116 - 1125.
7). Dhar A, et al. Gut 2022;71:1459-1487.
8). Hirano I, et al. Gastroenterology. 2020 Vol 158: 6. 1776 - 1786.
9). Molina-Infante J, et al. J Allergy Clin Immunol. 2018 Apr;141(4):1365-1372. (NOTE only 2018 not 2016)
10). Nowak-Węgrzyn A, et al. Journal Allergy & Clinical Immunology. 2017; Vol 139 No 4: 1111 – 1126.
11). Leonard SA, et al. World Allergy Organ J 2018 11, 4.
12). Caubet JC, et al. J Allergy Clin Immunol. 2014 Aug;134(2):382-9.
13). Connors L, et al. Allergy Asthma Clin Immunol. 2018 Sep 12;14(Suppl 2):56.
14). Mathew M, et al. Allergy Asthma Immunol Res. 2022 Nov;14(6):587-603.
15). Nowak-Węgrzyn A, et al. J Allergy Clin Immunol. 2019; Oct;144(4):1128-1130.
16). Meyer R, et al. Allergy. 2020; 75: 14– 32.
17). Nowak-Węgrzyn A, et al. J Allergy Clin Immunol. 2015;135(5):1114–24.
18). Tam J. J Food Allergy. 2020: 2:55–58.
19). Labrosse R, et al. Nutrients. 2020; 12(7):2086.[add number to visual]
20). Kokkonen J, et al. Acta Paediatr. 2004 Jul;93(7):880-6.
21). Dupont C. Ann Nutr Metab. 2018;73(suppl 4):8–16.
22). Elizur A, et al. Pediatr Allergy Immunol. 2012 Dec;23(8):766-70.
23). Arvola T, et al. Pediatrics. 2006 Apr;117(4):e760-8.
24). Xanthakos S, et al. Journal of Pediatric Gastroenterology and Nutrition. 2005;41(1):p 16-22.
[17:00] Jo Grvey (Guest)
25). Meyer R, et al. Pediatr Allergy Immunol. 2022;33:e13856. [add number to visual]
26). Milocco C, et al. Arch. Dis. Child. 1997, 77, 183.
27). Staiano A, et al. Arch. Dis. Child. 1995, 73, 439–442
28). Cavataio F, et al. J Pediatr Gastroenterol Nutr. 2000;30 Suppl:S36-44.
29). Nielsen RG, et al. J. Pediatr. Gastroenterol. Nutr. 2004, 39, 383–391.
30). Salvatore S, et al. Nutrients. 2021; Jan 21;13(2):297.
31). Rosen R, et al. J Pediatr Gastroenterol Nutr. 2018;66:516-554.
32). Omari T, et al. Journal of Pediatric Gastroenterology and Nutrition 2020: 70(4):p 489-496.


